- 點擊數:7374
- 發佈:2021-08-12

壹、前言
疫苗的發展成為2020年以來對抗新冠病毒危機最重要的希望,讓民眾接受施打疫苗能避免疫情擴大、恢復經濟、儘速達到全體免疫的效果。目前全球已有許多國家已經透過行政程序、立法授權,同意允許新冠病毒疫苗進行人體使用,預計在2021年之後會有更多國家正式核發疫苗讓民眾施打。
儘管疫苗成為新冠病毒的解方,但是在疫苗的發展與執行上仍存在許多問題。首先,以目前疫苗的生產數量並無法達到所有人都能接種,而政府施打疫苗的方式要如何達到公平正義呢?再者,目前有哪些疫苗是已經研發完成且能合法施打於人體呢?學界認為,為兼顧有效控制疫情與疫苗執行正義,至少有三項原則必須考量,首先,疫苗必須盡可能讓越多人接種越好,其次,疫苗研發後,其販售價格需讓購買者負擔得起,第三,所有疫苗均必須公平開放給全球所有有需要的國家人民接種。
基於各國亟欲控制新冠病毒疫情,疫苗有其施打的急迫性與重要性,本文旨在探討下列三個相關研究問題:第一,目前市場上有哪些疫苗?分別來自哪些研發單位?其獲得多少資金挹注研發疫苗?誰為資金贊助者?第二,目前有哪些疫苗已經研發並開始販售讓民眾接種?本文將針對目前已經在市場中的疫苗,討論其對抗新冠病毒的效力、生產數量、運輸保存必要條件、價格、授權情況、銷售情況、施打劑量等。第三,疫苗要施打,其程序必須符合公平正義,那政策推動者需要發展與執行疫苗施打的程序為何?本文將探究在政府推動疫苗接種政策時,將面臨哪些挑戰?
貳、疫苗研發單位與資金分佈之情況
在新冠病毒流行期間,許多藥廠在不到一年的時間內就成功地完成研發疫苗,這創下人類科技文明卓越成就一大步,過去要完成研發疫苗都至少需要花十年以上時間,但新冠病毒產生諾大公共衛生危機,促使史上最快速度完成對抗新冠病毒之疫苗的誕生。這樣的生產與研發效能均要歸功於新冠病毒疫情蔓延的嚴重性與各國傾力合作並挹注大量資金協助科學研發。
截至2021年2月3日,全球已經有289支對抗新冠病毒的疫苗進入實驗階段,而其中有66支疫苗在臨床第一期到第三期的試驗,在66支疫苗中,其中有20支疫苗已經進入第三期臨床試驗。66支疫苗裡面只有五支獲得世界衛生組織之嚴格規範下的授權(WHO, 2020b),包括牛津大學研發的AstraZeneca疫苗、BioNTech公司的Pfizer疫苗、Gamaleya疫苗、Moderna疫苗、與北京生物製劑研究所的Sinopharm疫苗(Wouters et al., 2021)。
另外,在66支疫苗中,其中5支疫苗分別來自中國、印度、哈薩克、與俄羅斯目前正在取得世界衛生組織核准列為可緊急使用、或預先具備資格(prequalification)的疫苗(Wouters et al., 2021),不過目前這5支疫苗均仍在審核階段(WHO, 2021)。另有其中兩支疫苗包括Novavax與嬌生Johnson & Johnson均在臨床第三階段試驗,展現其效能(efficacy)分別高達89.3%(Novavax Inc., 2021)與72%以上(Bai, 2021)。
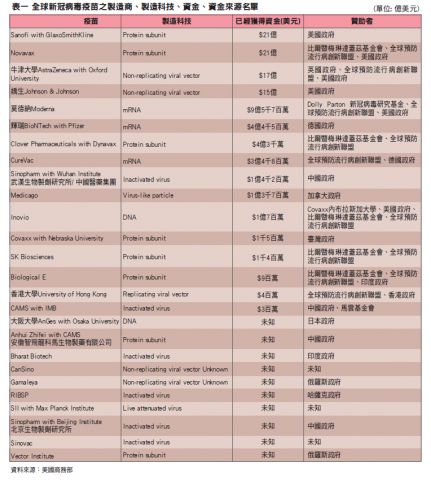
基於因應嚴峻新冠病毒之疫情,各國政府與非營利組織紛紛投入疫苗研發的行列,不管在資金、設備、行政資源、建設投資等方面都全力支援,並建立、擴張製造疫苗與分配疫苗的互通網絡,以迅速有效讓民眾得以接種疫苗。所有疫苗研發者總計獲得政府與非營利組織資金約一百億美元,其中前六大疫苗研發公司分別獲得來自美國政府、英國政府、全球預防流行病創新聯盟(The Coalition for Epidemic Preparedness Innovations)、與其他非營利研究組織的鉅額捐款(Wouters et al., 2021)。
具體而言,Sanofi with GlaxoSmithKline獲得美國政府21億美元資金。Novavax獲得比爾暨梅琳達蓋茲基金會、全球預防流行病創新聯盟、美國政府等21億美元資金。全球預防流行病創新聯盟、英國政府、美國政府等贊助17億美元協助研發牛津大學AstraZeneca疫苗。而Johnson & Johnson則獲得美國政府15億美元資金。另外,目前在美國民眾普遍接種其中一款的莫德納Moderna疫苗則獲得美國政府、全球預防流行病創新聯盟、Dolly Parton新冠病毒研究中心共計九億五千七百萬美元資金。尙有一支美國民眾普遍接種的輝瑞BioNTech with Pfizer疫苗,則獲得德國政府提供的四億四千五百萬美元資金。全球疫苗研發的資金來源大多數來自美國政府、全球預防流行病創新聯盟這兩個單位,其次來自於其他各國政府,包括英國、德國、日本、印度、臺灣、香港等等,最後尚有一些民間基金會諸如比爾暨梅琳達蓋茲基金會、馬雲基金會等亦提供大量資金研發(Wouters et al., 2021)。詳見表一。
參、疫苗發展與實施之過程
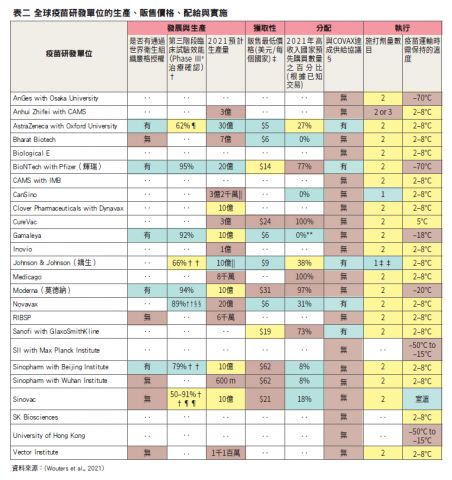
關於新冠病毒疫苗之發展與實施可以分下列七大面向,包括疫苗售價、產量、供給協議、銷售量、施打劑量、疫苗接受度、施打效能(Wouters et al., 2021)。首先,目前眾多市場上的疫苗中,售價最高的疫苗來自武漢生物製劑研究所/ 中國醫藥集團(Sinopharm)與北京生物製劑研究所,約62美元。第二高價為莫德納疫苗的31美元,價格最低廉則屬牛津大學AZ疫苗,要價5美元。其他各疫苗售價可見於表二。
其次,各疫苗中生產數量最多者為牛津大學AZ疫苗,共計有三十億。比起輝瑞疫苗、莫德納疫苗的二十億、十億多出許多。第三,目前與COVAX達成供給協議的疫苗僅有牛津大學AZ疫苗、輝瑞疫苗、嬌生疫苗、全球兩大疫苗廠賽諾菲(Sanofi)與葛蘭素史克(GlaxoSmithKline, GSK)合作之疫苗、Novavax等五支(如表二所示)。
第四,在疫苗預售方面,目前高收入國家預先收購比例最高的疫苗包括日本田邊三菱製藥位於加拿大的子公司Medicago 與德國CureVac藥廠等兩支疫苗,各有100%銷售率。另外,莫德納疫苗、輝瑞疫苗、與英國大藥廠葛蘭素史克(GlaxoSmithKline, GSK)則各有97%、77%、73%的銷售率(如表二所示)。
第五,在施打劑量上,目前市面上的疫苗均須施打第一劑之後,等約三週(輝瑞疫苗)或四週(莫德納疫苗)後,再施打第二劑,主要原因是打完第一劑之後抗體持續不久,仍有感染風險,需靠第二劑強化,以增加足夠的記憶T抗體達到完全免疫或終生免疫(Livingston, 2021)。唯一僅需施打一劑者有兩款疫苗:中國康希諾生物(CanSino Biologics)疫苗、美國嬌生疫苗。施打一劑的原因主要與嬌生疫苗使用的並非是核糖核酸(mRNA)技術,而為病毒載體(viral vector)技術的關係(Fox, 2021)。
第六,新冠病毒疫苗在世界各國的接受度如下(Wouters et al., 2021):最高者為越南(98%)、 印度 (91%)、中國 (91%)、 丹麥 (87%)、與南韓(87%)等。而最低者為賽爾維亞(38%)、克羅埃西亞(41%)、法國(44%)、黎巴嫩 (44%)、以及巴拉圭(51%)等
最末,目前就對抗新冠病毒的疫苗效能而言,以輝瑞疫苗的95.6%,莫德納疫苗的94.5%為最高。莫德納疫苗甚至對亞裔、非裔、拉丁裔族群具有100%對抗新冠病毒之抵抗力(Kaplan, 2020)。這兩種疫苗均使用mRNA 全名為信使 RNA(message RNA)而製造(Isaacson, 2021),輝瑞疫苗在2020年12月11日最先獲得美國食品藥物管理局(FDA) 緊急使用授權(Emergency Use Authorizations,簡稱EUA)的第一支mRNA 疫苗(FDA, 2021b),因為mRNA 疫苗並無有製造新冠病毒的核酸(nucleic acid)、且不會進入人體細胞核,所以施打該疫苗不會讓人感染新冠病毒,所有十六歲以上成年人均能施打,儘管世界衛生組織認為孕婦與哺乳婦女對疫苗應持觀望態度,但美國拜登總統首席醫療顧問佛奇佛奇博士(Anthony Fauci)指出沒有任何科學證據證實疫苗會對懷孕產生任何危險,研究顯示懷孕婦女接種疫苗是安全的。美國目前已逾十萬名懷孕婦女接受施打疫苗。輝瑞業已在2021年2月開始針對懷孕婦女進行臨床實驗,預估在2023年1月完成實驗(Ellis, 2021)。而莫德納疫苗也迅速在2020年12月18日,繼輝瑞疫苗之後成為第二支獲得EUA的mRNA 疫苗(FDA, 2021a),適用於所有成年人,目前甚至有身為醫療照護人員的孕婦施打後,體內胎兒甚至能獲得抗體的情況(Gilbert & Rudnick, 2021)。
肆、疫苗政策制定之原則
新冠病毒的傳染途徑可透過人體唾液、飛沫或肢體接觸所感染,造成巨大的公共健康危機、經濟損害、與社交生活障礙。有效的疫苗接種有助於降低全球人民免於新冠病毒感染所帶來的重症與住院率,甚至於理想上能達到群體免疫。目前已經有不少疫苗通過授權能進行人體施打,且有很多進入臨床發展的最後階段。不過,目前合法核發能使用的疫苗並不足以讓所有人都獲得施打,當疫苗政策從研發到執行時,必須考量下列四個面向:發展與生產合法授權、價格可負擔、產量需求供給與分配平均、使用效能良好(Wouters et al., 2021)。
具體來說,在疫苗生產與發展方面需具備兩要素(Wouters et al., 2021),第一,必須經過世界衛生組織嚴格審查與合法授權,包括針對因應公共衛生危機之緊急使用,例如疾病大流行(pandemics)時,第二,大規模量產。在價格方面,首先價格反映公共投資與風險共同承擔,其次,制定價格前必須將大規模販售納入考量。在產量需求供給分配方面,必須包括兩個條件:有需要者就能獲得疫苗、支持多邊協議(multilateral initiatives)以確保能即時在全球提供疫苗有效的供應管道。在效能上,首先,基礎設備上必須確保讓每劑疫苗在每個當地與區域有效能地分配。其次,要建立公眾對疫苗的信心,讓民眾能各廣泛接種疫苗。
伍、結論
歷史上關於疫苗的研發,其資金總是不足的。然而,此次新冠病毒全球大流行顯然與過去疫苗資金挹注不足大相徑庭。儘管每支疫苗都獲得政府或民間基金會等鉅額資金投資,不過卻仍面對各種挑戰。首先,各疫苗之售價、產量、供給協議與否、銷售量、施打劑量、施打效能均不一。普遍來說,各疫苗目前的施打後可獲得抗體的效能大致上展現良好,但是能提供給民眾施打的劑量差距甚大、價格也很懸殊,這將對誰買得起、誰具有優先施打權之疫苗政策的正義性影響莫大。
其次,對疫苗市場的製造商而言,彼此是否競爭、共享智慧財產權、資訊、與技術亦攸關著疫苗生產的速度與配給量。世界衛生組織成立一個新冠病毒科技取得平台(COVID-19 Technology Access Pool)(WHO, 2020a),期望能讓所有關於對抗新冠病毒疫情的科技進行智慧財產權共享,不過,截至2021年2月,並沒有任何製造商願意分享任何關於新冠病毒疫情的技術訊息(Wouters et al., 2021),此疫苗發展之商業競爭結果將與全球疫情發展與控制有顯著關連。
最後,執行疫苗政策不僅要留意讓疫苗生產、發展過程、售價、產量等執行階段均須符合公平正義,讓最可能重症、醫護人員、以及最弱勢者優先施打之外,執行疫苗政策,最重要的是要建立民眾對疫苗的信心,因為對抗新冠病毒疫情的成敗在於全球多少人真正接種疫苗。但根據目前研究調查,全球各國對疫苗信心度懸殊過大,有高達九成者,亦有低於四成者(Lazarus et al., 2021),此將與日後能否早日結束疫情息息相關。
參考書目
Bai, N. (2021). How Effective Is the Johnson & Johnson COVID-19 Vaccine? Here’s What You Should Know. UC San Francisco. https://www.ucsf.edu/news/2021/03/420071/how-effective-johnson-johnson-covid-19-vaccine-heres-what-you-should-know
Ellis, R. (2021). Pfizer Starts COVID Vaccine Trials In Pregnant Women. WebMD Health News. https://www.webmd.com/vaccines/covid-19-vaccine/news/20210222/pfizer-starts-covid-accine-trials-in-pregnant-women
FDA. (2021a). Moderna COVID-19 Vaccine. FDA. https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/moderna-covid-19-vaccine
FDA, O. of the. (2021b). Pfizer-BioNTech COVID-19 Vaccine. FDA. https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/pfizer-biontech-covid-19-vaccine
Fox, M. (2021). How the Johnson and Johnson vaccine is different from the others: Dosage, efficacy, protection, technology—ABC11 Raleigh-Durham. CNN. https://abc11.com/johnson-and-vaccine-covid-pfizer/10379441/
Gilbert, P., & Rudnick, C. (2021). US woman gives birth to first known baby with Covid antibodies, doctors say | Florida | The Guardian. The Guardian. https://www.theguardian.com/us-news/2021/mar/16/florida-woman-vaccine-dose-baby-covid-coronavirus-antibodies
Isaacson. (2021). How mRNA Technology Gave Us the First COVID-19 Vaccines | Time. Time. https://time.com/5927342/mrna-covid-vaccine/
Kaplan, K. (2020). How the Moderna and Pfizer COVID-19 vaccines compare—Los Angeles Times. Los Angeles Times. https://www.latimes.com/science/story/2020-12-15/how-the-covid-19-vaccines-from-moderna-and-pfizer-compare-head-to-head
Lazarus, J. V., Ratzan, S. C., Palayew, A., Gostin, L. O., Larson, H. J., Rabin, K., Kimball, S., & El-Mohandes, A. (2021). A global survey of potential acceptance of a COVID-19 vaccine. Nature Medicine, 27(2), 225–228. https://doi.org/10.1038/s41591-020-1124-9
Livingston, E. H. (2021). Necessity of 2 Doses of the Pfizer and Moderna COVID-19 Vaccines. JAMA, 325(9), 898. https://doi.org/10.1001/jama.2021.1375
Novavax Inc. (2021). Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial. Novavax Inc. https://ir.novavax.com/news-releases/news-release-details/novavax-covid-19-vaccine-demonstrates-893-efficacy-uk-phase-3
WHO. (2020). COVID-19 technology access pool. https://www.who.int/initiatives/covid-19-technology-access-pool
WHO. (2020). List of Stringent Regulatory Authorities (SRAs). WHO. http://www.who.int/medicines/regulation/sras/en/
WHO. (2021). Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process. https://extranet.who.int/pqweb/sites/default/ files/documents/Status_COVID_VAX.pdf
Wouters, O. J., Shadlen, K. C., Salcher-Konrad, M., Pollard, A. J., Larson, H. J., Teerawattananon, Y., & Jit, M. (2021). Challenges in ensuring global access to COVID-19 vaccines: Production, affordability, allocation, and deployment. The Lancet, 397(10278), 1023–1034. https://doi.org/10.1016/S0140-6736(21)00306-8
作者 黃芳誼 為佛羅里達大學社會學博士




